Technika uzdatniania wody

WODY PODZIEMNE
Zawierają często podwyższone, przekraczające normę dla wód do picia i na potrzeby gospodarcze, stężenia substancji mineralnych i/lub organicznych pochodzenia naturalnego (neogenicznego) lub antropogenicznego. Spośród substancji pochodzenia naturalnego przekroczenia normy dotyczą najczęściej żelaza i manganu, niekiedy również azotu amonowego, substancji organicznych (barwa), siarkowodoru i siarczanów (VI). W zakresie zanieczyszczeń antropogenicznych podstawowy problem stanowią azotany(V) pojawiające się w znacznych ilościach w szczególności na terenach intensywnego rolnictwa oraz nieskanalizowanego osadnictwa. Stosunkowo często pojawiają się również zanieczyszczenia azotem amonowym i siarczanami (VI).
Wykorzystanie wód podziemnych wiąże się więc najczęściej z koniecznością ich uzdatniania. Jest ono stosunkowo proste, jeśli dotyczy żelaza i manganu, i można zrealizować je za pomocą napowietrzania oraz filtracji na filtrach ciśnieniowych w układzie zamkniętym. Wszelkie inne technologie komplikują procesy uzdatniania, a możliwość ich wykorzystania, szczególnie na małych ujęciach wiejskich, jest ze względów ekonomicznych ograniczona. Dotyczy to w szczególności wód zanieczyszczonych azotanami (V), ale także wód zawierających znaczne ilości substancji organicznych, azotu amonowego, a także żelaza i manganu.
Z uwagi na przeznaczenie zasobów wód powierzchniowych, jak i podziemnych do celów konsumpcyjnych i na potrzeby gospodarcze, obecność w nich bakterii jest najczęściej zjawiskiem niepożądanym. Niewskazana jest obecność bakterii zarówno heterotroficznych z grupy form chorobotwórczych (np. z rodzaju Salmonella), jak i saprofitycznych (np. promieniowców), których funkcje metaboliczne wywołują niekorzystne zmiany składu chemicznego wód (np. smak, zapach). Niepożądana jest też obecność chemoautotrofów (np. bakterii żelazowych, siarkowych), powodujących uszkodzenia, a niekiedy zniszczenie urządzeń (korozja) niezbędnych do eksploatacji danego źródła wody.
Biorąc pod uwagę występowanie mikroflory w środowisku naturalnym, jest ona znacznie uboższa w przypadku wód podziemnych w porównaniu ze zbiornikami powierzchniowymi, zarówno pod względem ilościowym, jak i jakościowym (zróżnicowaniem gatunkowym).
Doniesienia z ostatniego dwudziestolecia informują jednak o coraz liczniejszym występowaniu bakterii w wodach podziemnych, będącym wynikiem wzrostu zanieczyszczenia tych ostatnich. Flora bakteryjna stanowi dominujący element wśród organizmów tam występującym. W przypadku zanieczyszczenia wód materią organiczną zaczynają w nich dominować bakterie heterotroficzne. Niekiedy zwiększone ilości bakterii obserwuje się także w warunkach naturalnych, charakteryzujących się podwyższonymi stężeniami związków mineralnych. Są to m.in. bakterie wiążące żelazo, utleniające mangan oraz utleniające lub redukujące związki siarki. Ich wzmożony rozwój wpływa niekorzystnie na urządzenia wodociągowe i na jakość ujmowanych wód.
Bakterie występujące w wodach podziemnych wymagające usunięcia:
Promieniowce (Actinomycetales):
Należą do drobnoustrojów niezwykle uciążliwych w odniesieniu do wód zarówno podziemnych, jak i powierzchniowych. Rozkładając wielocząsteczkowe związki organiczne (chitynę, błonnik, ligniny, kwasy huminowe i fulwowe), wydzielają one do wody nieprzyjemny zapach, określany jako ziemisty, pleśniowy lub stęchły.
Bakterie żelazowe:
Występują one najczęściej w wodach podziemnych niż w powierzchniowych. Mogą także bytować w studniach, przewodach wodociągowych i w złożu filtracyjnym na stacjach uzdatniania wody. Do najczęściej spotykanych w wodach studziennych należą rodzaje: Galionella, Leptrothrix, Crenothrix, Clonothrix, Sphaerotilus, Siderocapsa, Sideromonas, Naumanniella i Thiobacillus (Ferrobacilus). Stanowią one niekiedy niekorzystny czynnik biologiczny w eksploatacji ujęć wody. Ich obecność w zwiększonych ilościach wpływa wyraźnie na barwę, smak i zapach wody.
Ilości komórek np. Galionella sp. dochodzące do 4700 w 1ml nie powodują jeszcze zmiany cech organoleptycznych, przy około 10000 tych bakterii w 1ml zauważa się pojawienie jasnordzawego zabarwienia wody, a przy ok. 80000 jasnobrązowego. Zmienia się przy tym również zapach (na specyficzny) i posmak na lekko cierpki. Tak duże ilości bakterii występują jedynie podczas płukania sieci wodociągowej oraz przy nagłym zwiększaniu ciśnienia wody.
Bakterie manganowe:
Obok bakterii żelazowych ważną rolę w powstawaniu osadów w studniach i sieci wodociągowej odgrywają bakterie manganowe. Mogą one przyczyniać się również do powstawania niekorzystnych zmian cech organoleptycznych wody (metaliczny posmak, wzrost barwy i mętności). Występują one w wodach i osadach dennych zbiorników oraz w glebach bagiennych i bogatych w materię organiczną. W urządzeniach wodociągowych obserwuje się często efektywne odkładanie osadów zawierających mangan bez udziału klasycznych bakterii manganowych. Wybrane bakterie żelazowe (np. Sphaerotilus manganifera), łącząc zdolność utleniania soli żelaza (II) i manganu (II), kumulują w swych pochewkach wodorotlenek manganu (III) obok wodorotlenku żelaza (III). W świeżych osadach żelazowo-manganowych o luźnej, gąbczastej konsystencji wykrywa się często duże ilości bakterii żelazowych, podczas gdy w starych , silniej przylegających do ścian przewodów spotyka się tylko nieliczne, silnie zmacerowane szczątki tych mikroorganizmów . Zmniejszenie się wydajności studni jako wynik kolmatacji, na skutek rozwoju bakterii żelazowych i manganowych, było bardzo częstym zjawiskiem obserwowanym w Stanach Zjednoczonych, w rejonach położonych nad Zatoką Meksykańską, nad Atlantykiem i Oceanem Spokojnym.
Bakterie siarkowe:
Przedstawiciele tej grupy biorą udział w przemianach związków siarki. W wodach powierzchniowych spotyka się fotosyntetyzujące bakterie siarkowe purpurowe i zielone. Jedynie przypadkowo pojawiają się one w wodach podziemnych, ze względu na brak światła. Dostępu światła nie wymagają natomiast bakterie siarkowe autotroficzne chemosyntetyzujące oraz mikotroficzne i heterotroficzne. Wśród bakterii chemosyntetyzujących wyróżnia się bezbarwne nitkowate bakterie zwane siarkowodorowymi oraz nietworzące form nitkowatych bakterie tionowe. Do najpospolitszych bakterii siarkowodorowych zalicza się rodzaje: Beggiatoa, Tioploca i Thiothrix, odgrywające ważną rolę w zarastaniu i tworzeniu osadów w rurach wodociągowych i studniach.
Wody podziemne stanowią optymalne środowisko dla rozwoju bakterii redukujących siarczany (VI) w warunkach braku tlenu, przy niskim potencjale redoks oraz zawartości związków organicznych. W warunkach beztlenowych, wyniku dysymilacyjnej redukcji siarczanów(VI) wytwarza się siarkowodór (H2S), który reaguje z obecnymi w wodzie jonami metali, np. żelaza (II), tworząc trudno rozpuszczalny osad siarczku żelaza (II) (FeS).Najczęściej spotykanym gatunkiem cechującym się dużą aktywnością biochemiczną jest Desulfovibrio desulfuricans. Bakterie z rodzaju Desulfovibrio są czynnikiem korozji rur wodociągowych w warunkach beztlenowych. Oprócz desulfurykatorów mezofilnych są również bakterie redukujące siarczany (VI) w temperaturach podwyższonych, np. beztlenowiec Desulfotomaculum nigrificans aktywnie rozwija się przy optimum termicznym +55°C, wywołując przy tym zakłócenia w systemach grzewczych.
Działalność bakterii redukujących siarczany (VI) zdecydowanie obniża właściwości organoleptyczne wody do picia, wskutek nadawania jej nieprzyjemnego zapachu siarkowodorowego.
Dodatkowe uzdatnianie wody wodociągowej u odbiorców
All video
Do doczyszczania wody wodociągowej służą domowe stacje doczyszczania wody, popularnie zwane filtrami domowymi, stosowanie których ma na celu usunięcie skutków wtórnego zanieczyszczenia wody w systemach wodociągowych oraz polepszenie jakości wody do picia. Domowe stacje doczyszczania wody dostępne są w zróżnicowanych układach technologicznych. W filtrach domowych mogą zachodzić procesy filtracji, sorpcji, wymiany jonowej, odwróconej osmozy, utleniania i mineralizacji wody. Nie oznacza to, że w każdym filtrze zachodzą te procesy łącznie.
Dobór konkretnego rozwiązania stacji doczyszczania wody zależy od jakości wody ujmowanej oraz od przeznaczenia wody. W procesie doczyszczania wody zakłada się konieczność usuwania z niej grubych zanieczyszczeń mechanicznej (np. rdza, piasek), zawiesin organicznych oraz mineralnych (wytrąconych tlenków i wodorotlenków metali żelaza, cynku i manganu), rozpuszczonych substancji organicznych i mineralnych, związków chloru, jonów wapnia i magnezu powodujących twardość węglanową wody, bakterii oraz końcowego wzbogacania wody w jony wapnia, czasami pozbawionej ich w wyniku przeprowadzonych procesów doczyszczania.
W celu realizacji wymienionych zadań stosuje się procesy filtracji, sorpcji, wymiany jonowej, odwróconej osmozy, utleniania, wzbogacania. W jednym urządzeniu może być przeprowadzony jeden proces lub kilka procesów prowadzonych w odpowiedniej kolejności.
PODSTAWOWE PROCESY TECHNOLOGICZNE
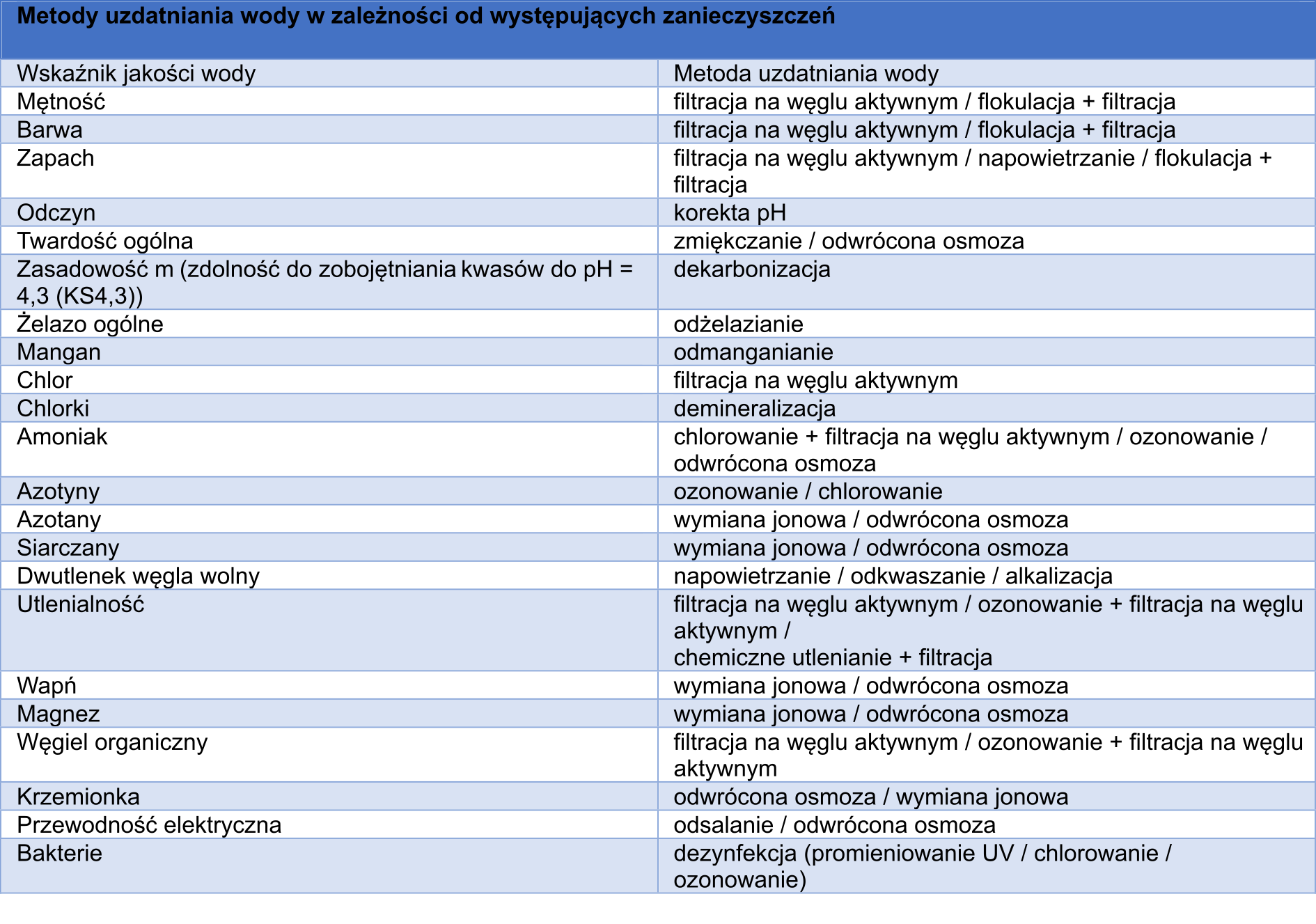
Metody uzdatniania wody
Uzdatnianie wody polega na dostosowaniu jej właściwości fizykochemicznych do wymagań wynikających z jej przeznaczenia. Podstawowym czynnikiem decydującym o sposobie uzdatniania wody jest jej skład. Dlatego przed doborem technologii i uzdatniania wody konieczne jest wykonanie analizy fizykochemicznej przez profesjonalne laboratorium. Badania takie wykonują stacje sanitarno-epidemiologiczne, laboratoria kontroli środowiska lub laboratoria na wyższych uczelniach. Od prawidłowej oceny składu wody zależy dobór odpowiednich filtrów oraz efektywność usuwania z niej zanieczyszczeń.
PODSTAWOWE WSKAŹNIKI JAKOŚCI WODY
Mętność - wskaźnik jakości wody określany w mętnościomierzu Borisa przez porównanie badanej wody z odpowiednio przygotowanymi wzorcami; za jednostkę mętności przyjęto taka mętność, jaka powstaje, jeżeli do 1 dm3 wody destylowanej doda się 1 mg zawiesiny ziemi okrzemkowej lub kaolinu.
Barwa - wskaźnik jakości wody wyrażony w jednostkach barwy, tj. stopniach skali platynowo-kobaltowej (1° odpowiada barwie, jaka nadaje 1 mg Pt w postaci soli rozpuszczonej w 1 dm3 wody). Barwa wody jest wywołana obecnością substancji barwnych dostających sie do wody wraz ze ściekami, substancjami organicznymi pochodzącymi z gleby, związkami żelaza, koloidami albo zakwitami.
Zapach - wskaźnik jakości wody określany organoleptycznie za pomocą powonienia na podstawie skali natężenia zapachu: oznacza sie na zimno (z) lub na gorąco (g). podając natężenie zapachu wg 5-stopniowej skali:
- 0 - brak zapachu;
- 1 - zapach bardzo słaby;
- 2 - zapach słaby;
- 3 - zapach wyraźny;
- 4 - zapach silny;
- 5 - zapach bardzo silny.
Należy również wskazać grupę zapachu wg następującej klasyfikacji:
R - zapachy roślinne pochodzenia naturalnego, wywołane związkami organicznymi, które nie znajdują się w stanie rozkładu gnilnego (np. zapach ziemi, mchu, siana, torfu, kory drzewnej, zapach kwiatów itp.);
G - zapachy gnilne pochodzenia naturalnego, spowodowane obecnością * wodzie substancji organicznych znajdujących sie w stanie rozkładu gnilnego {np. zapach stęchły, zbutwiały, zapach pleśni, zgniłych jaj, fekalny, itp.);
S - zapachy pochodzenia nienaturalnego, specyficzne, wywołane obecnością związków niespotykanych w wodzie, jak fenol, nafta, chlor itp.
Odczyn - wyraża stopień kwasowości lub zasadowości wody i jest określany ilościowo stężeniem jonów wodorowych: pH=-lg [H+]
Oznaczenie pH - wykonuje sie kolorymetrycznie lub elektrometrycznie. Wody o niskim odczynie pH odznaczają sie korozyjnością, natomiast wody o wysokim odczynie pH wykazują skłonność do pienienia się.
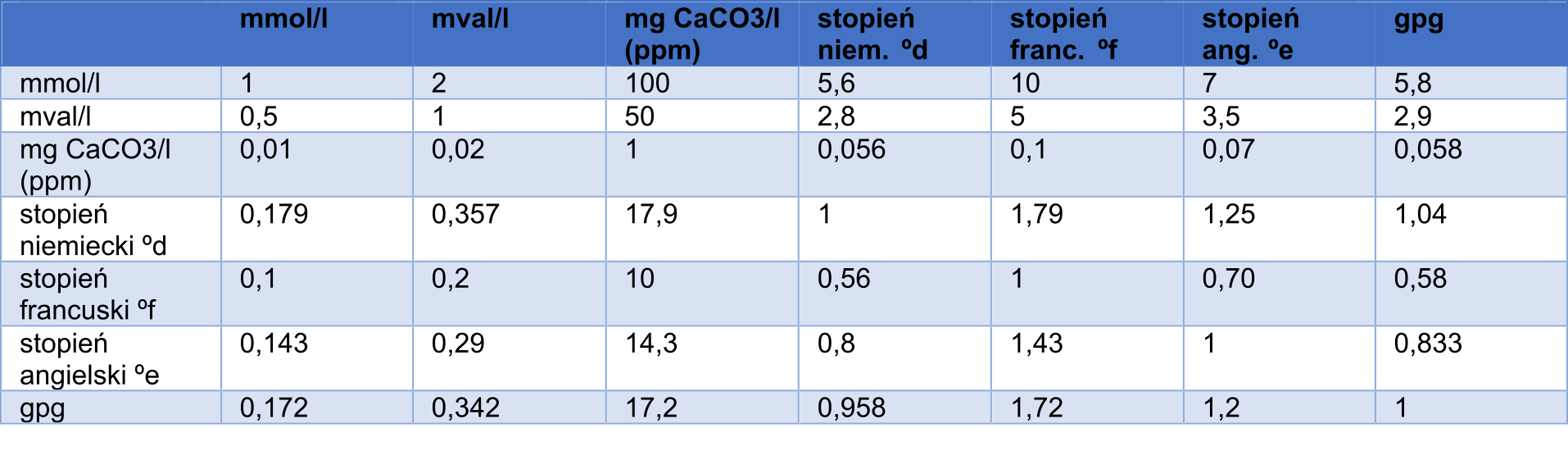
Twardość ogólna (całkowita) - właściwość wywołana obecnością substancji rozpuszczonych w wodzie, głównie soli wapnia i magnezu (również innych kationów, które występują jednak w dużo mniejszych ilościach, takich jak jony: żelaza, glinu, manganu oraz metali ciężkich). Twardość wody określa sie zawartością rozpuszczonych w niej soli wapnia i magnezu, wyrażonych w mval/dm3 (1 mg Ca2+/dm3 odpowiada 0,05 mval/dm3, a 1 mg Mg2+/dm3 - 0,082 mval/dm3).
Jednostki twardości - TABELA PRZELICZENIOWA
Klasyfikacja wody wg jej twardości

Twardość ogólna - klasyfikuje sie wg kationów (twardość wapniowa i twardość magnezowa) lub wg anionów (twardość węglanowa i twardość nie węglanowa).
Twardość ogólna jest suma twardości węglanowej i niewęglanowej lub sumą twardości wapniowej i magnezowej.
Twardość węglanowa (przemijająca) - jest spowodowana obecnością rozpuszczonych w wodzie wodorowęglanów, węglanów i wodorotlenków wapnia i magnezu. Podczas podgrzewania wodorowęglany wapnia i magnezu wytrącają sie częściowo z roztworu w wyniku odwracalnych reakcji rozkładu i hydrolizy. W wyniku tych reakcji twardość ulega obniżeniu.
Twardość niewęglanowa (stała) - jest spowodowana obecnością rozpuszczonych w wodzie chlorków, siarczanów i krzemianów wapnia i magnezu (nie rozkładają się i nie wytrącają z roztworu podczas podgrzewania wody).
Nadmierna twardość - wody jest przyczyną powstawania kamienia kotłowego w urządzeniach pracujących na zasadzie wymiany ciepła ( zmniejszenia wydajności procesu grzewczego), pralkach, zmywarkach do naczyń, bojlerach, rurach, na armaturach i ceramice sanitarnej. W urządzeniach pracujących na zasadzie wymiany ciepła, osady wapnia i magnezu powodują duże straty energii (1 mm warstwy osadów zwiększa zużycie energii o ok. 10%). Dodatkowo, osady w rurach wodociągowych stanowią idealne środowisko dla rozwoju najróżniejszych mikroorganizmów. Nadmierna twardość wody jest również przyczyną większego zużycia środków myjąco-piorących.
Zgodnie z zaleceniami Światowej Organizacji Zdrowia (WHO) oraz polskimi normami (Rozporządzenie Ministra Zdrowia z dnia 7 grudnia 2017 r. (Dz.U. 2017 poz. 2294) twardość ogólna wody do picia powinna wynosić 60–500 mg CaCO3/l.
Zasadowość [alkaliczność) - wskaźnik określający zawartość wodorotlenków, wodorowęglanów i węglanów metali alkalicznych (Na, K) i metali ziem alkalicznych |Ca, Mg). Zasadowość wody wyraża sie w mval/dm3 i oznacza miareczkując 100 cm3 wody 0,1-normalnym kwasem solnym lub siarkowym wobec fenoloftaleiny {zasadowość p), a następnie wobec oranżu metylowego (zasadowość m). Zasadowość p (zmiana barwy przy pH = 8.2) uwzględnia wszystkie alkalicznie reagujące składniki wody, które dysocjują z wydzielaniem jonów OH-, zasadowość m zaś (zmiana barwy przy pH = 4,3) obejmuje takie występujące w wodzie związki, które reagują z kwasem solnym aż do uzyskania punktu zobojętnienia wobec oranżu metylowego.
Żelazo, mangan - w wodach naturalnych występują przeważnie w postaci węglowodorów, siarczanów, chlorków, związków humusowych i niekiedy fosforanów. Obecność jonów żelaza i manganu jest bardzo szkodliwa dla wielu procesów technologicznych, szczególnie w przemyśle papierniczym, włókienniczym i produkcji błon fotograficznych. Ponadto zawartość żelaza i manganu w wodzie może powodować rozwój bakterii żelazistych i manganowych, których kolonie mogą być przyczyna zarastania przewodów wodociągowych.
Chlorki - zawartość chlorków w wodzie może być wywołana wymywaniem pokładów chlorków bądź też mogą się w niej pojawić wskutek obecności ścieków. Najczęściej chlorki w wodach powierzchniowych występują, jako NaCI, CaCl2 i MgCl2, przy czym zawsze w postaci związków rozpuszczonych.
Związki azotu (amoniak, azotyny, azotany) - powstają głównie z substancji białkowych, które dostają sie do wody z doprowadzanymi ściekami. Amoniak występujący w wodzie może być pochodzenia organicznego lub nieorganicznego. Jeżeli jest on pochodzenia organicznego, obserwuje sie podwyższoną utlenialność.
Azotyny - powstają głównie na skutek utleniania amoniaku w wodzie, mogą również przedostawać się sie do niej wraz z woda deszczowa na skutek redukcji azotanów zawartych w glebie.
Azotany - stanowią produkt biochemicznego utleniania amoniaku i azotynów bądź też mogą być wyługowane z gleby.
Siarkowodór - nadaje wodzie nieprzyjemny zapach, powoduje rozwój bakterii siarkowych oraz wywołuje korozje. Siarkowodór występujący zazwyczaj w wodach podziemnych, może być pochodzenia mineralnego, organicznego lub biologicznego, przy czym przybiera postać rozpuszczonego gazu lub siarczków. Postać występowania siarkowodoru w wodzie zależy od pH:
- przy pH<5 ma postać H2S;
- przy pH>7 występuje, jako jon HS-;
- przy pH = 5 - 7 może występować, jako H2S lub HS-,
Siarczany - obok chlorków najbardziej rozpowszechnione zanieczyszczenia w wodzie. Dostają sie one do niej wskutek wymywania skal osadowych, wyługowania gleby oraz niekiedy na skutek utleniania siarczków i siarki stanowiących produkty rozkładu białka pochodzącego ze ścieków. Znaczna zawartość siarczanów w wodzie może powodować choroby przewodu pokarmowego, a ponadto woda taka może być przyczyna korozji betonu i konstrukcji żelbetowych.
Dwutlenek węgla - zależnie od odczynu wody może występować w następujących postaciach:
- przy pH<4 - głównie, jako CO2 gazowy;
- przy pH = 8,4 - głównie w postaci jonu wodorowęglanowego HC03-;
- przy pH> 10,5 - głównie, jako jon węglanowy CO32-.
Dwutlenek węgla agresywny - cześć wolnego dwutlenku węgla, która jest niezbędna do zabezpieczenia rozpuszczonych w wodzie wodorowęglanów przed rozkładem. Jest bardzo aktywny i powoduje korozje metali. Ponadto powoduje on rozpuszczanie węglanu wapnia CaCO3 w zaprawach lub betonie i dlatego powinien być usunięty z wody przeznaczonej do celów budowlanych. Przy ocenie agresywności wody, obok stężenia agresywnego dwutlenku węgla, należy uwzględniać również zawartość soli w wodzie. Woda o takiej samej zawartości agresywnego CO2 jest tym agresywniejsza, im większa jest w niej zawartość soli.
Utlenialność - umowny wskaźnik jakości wody, określający zawartość w wodzie substancji utleniających się nadmanganianem potasu KMn04 i wyrażony w mg 02/dm3 badanej wody lub w mg zużytego KMn04 na dm3 (1 mg KMn04 odpowiada 0,25 mg O2).
Sucha pozostałość - pozostałość po odparowaniu wody, wysuszona w temperaturze 105°C i przeliczona na 1 dm3 wody Składają sie na nią wszystkie substancje stale, rozpuszczone i zawieszone w wodzie.
Pozostałość po prażeniu - pozostałość po prażeniu suchej pozostałości w temperaturze 550*C (wypalane zostają wszystkie substancje organiczne).
Strata po prażeniu - umowny wskaźnik zawartości związków organicznych w wodzie.
Przewodność elektryczna - jest wywołana obecnością jonów powstałych w wyniku dysocjacji rozpuszczonych soli oraz amoniaku i dwutlenku węgla. Jednostką przewodności jest S/cm (μS/cm). Przewodność elektryczna należy podawać dla temperatury 20°C. Może być podstawą oceny umownego stężenia NaCI wg zależności:
1 μS/cm = 0,55 mg NaCI/dm3
Przewodność elektryczna wody
Przewodność wody jest ważną właściwością, z której można wyciągnąć wnioski dotyczące jakości wody. Zasadniczo czysta woda nie przewodzi prądu, to znaczy nie przewodzi prądu. Tylko substancje rozpuszczone w wodzie, takie jak chlorki, siarczany czy węglany sprawiają, że woda jest przewodząca. Mierząc to przewodnictwo, można wyciągnąć wnioski na temat ilości cząstek rozpuszczonych w wodzie. Im więcej cząstek rozpuści się w wodzie, tym wyższa przewodność wody. Można też powiedzieć, że im bardziej zanieczyszczona woda, tym wyższa przewodność.
Pomiar przewodności wody oczywiście nie zastąpi precyzyjnej analizy chemicznej substancji rozpuszczonych w wodzie. Przewodność daje jedynie wskazanie bezwzględnej liczby cząstek rozpuszczonych w wodzie. Są też substancje rozpuszczone w wodzie, takie jak hormony, fungicydy czy pestycydy, które nie przewodzą prądu i dlatego nie są rejestrowane przez przewodnictwo.
Podsumowując, można powiedzieć, że przewodność jest dobrym wskaźnikiem czystości wody. Im niższe przewodnictwo, tym mniej cząstek rozpuszcza się w wodzie. Jednak czysta woda jest rozpuszczalnikiem, który ma właściwość natychmiastowego ponownego przyciągania cząstek, a tym samym osiągania przewodności. Dlatego czysta lub czysta woda ma zawsze określoną przewodność.
Mikrosiemens jako jednostka przewodnictwa
Przewodność wody można określić jako przewodność elektryczną w mikrosimensach lub jako opór elektryczny w omach. Jednak te dwie wartości są współzależne: im wyższa rezystancja, tym niższa przewodność (i odwrotnie).
Wartość TDS jest często podawana w połączeniu z przewodnością wody. Słowo TDS oznacza angielskie wyrażenie „całkowita ilość rozpuszczonych ciał stałych” i oznacza liczbę rozpuszczonych (organicznych i nieorganicznych) ciał stałych w wodzie. Wartość TDS podawana jest w jednostkach ppm (części na milion), tj. liczba rozpuszczonych cząstek na milion cząsteczek wody.
Aby określić przewodność wody, miernik przewodności mierzy opór elektryczny wody. Wartość ta jest następnie przeliczana na przewodność w mikrosimensach na cm lub wartość TDS w ppm. W przybliżeniu wartość 2 mikrosimensów odpowiada około 1 cząsteczce na milion cząsteczek wody. W celu prawidłowego obliczenia przewodności lub przeliczenia na wartość TDS, profesjonalny miernik przewodności powinien również mierzyć temperaturę wody. Bez tego pomiaru temperatury mogą wystąpić błędy pomiaru i konwersji.
Mierząc opór elektryczny wody, można wyciągnąć wnioski na temat przewodności, a tym samym liczby cząstek rozpuszczonych w wodzie. Im wyższa przewodność w mikrosimensach, tym woda jest bardziej nasycona cząstkami.
Ze względu na wiele składników normalna woda mineralna ma średnią przewodność od 400 do 2000 mikrosimensów i rezystancję od 500 do 2500 omów. Woda z kranu wstępnie oczyszczona przez wodociąg ma przewodność od 250 do 1000 mikrosimensów i rezystancję od 1000 do 4000 omów, w zależności od stopnia twardości.
Funkcja czystej wody
Przewodnictwo wody jest zatem dobrym wskaźnikiem czystości wody. Wszelkie zanieczyszczenia takie jak minerały, sole czy zanieczyszczenia zwiększają przewodność lub zmniejszają rezystancję. Na przykład woda źródlana, uosobienie czystej i zdrowej wody, ma przewodność od 80 do 130 mikrosimensów i rezystancję od 7700 do 12500 omów.
Przewodność wody pitnej dostarcza informacji o tym, czy woda w organizmie może wchłaniać i transportować substancje. Według badań naukowych prof. Louis-Claude Vincent zdrowa woda pitna powinna mieć przewodność nie większą niż 160 mikrosimensów lub rezystancję co najmniej 6000 omów. Przy przewodności powyżej 160 mikrosimensów wskaźnik zachorowań w populacji znacznie wzrasta.
Zdolność absorpcyjna komórek organizmu zależy od nasycenia wody obcymi substancjami. Od pewnego stopnia nasycenia, wyrażonego przewodnictwem, woda nie może już penetrować komórek poprzez osmozę i rozwijać swoje działanie detoksykujące. Im niższa przewodność wody, tym lepiej może ona spełniać swoją funkcję, odrywając i usuwając z komórki toksyny, produkty przemiany materii i kwasy.
Woda o przewodności nie większej niż 120 mikrosimensów lub rezystancji co najmniej 8300 omów jest szczególnie łatwo wchłaniana przez komórki organizmu. Z przewodności ponad 300 mikrosimensów woda nie może już spełniać swojej funkcji w komórce. Optymalna przewodność dla organizmu człowieka wynosi około 130 mikrosimensów.
Wartości graniczne przewodności w wodzie pitnej
W ostatnich latach w Niemczech wartości graniczne przewodności wody zostały kilkakrotnie podniesione. Norma UE przewidywała wartość graniczną przewodności 400 mikrosimensów do 2013 roku. Dla Światowej Organizacji Zdrowia taki limit wynosi 750 mikrosimensów. W niemieckim rozporządzeniu w sprawie wody pitnej do 30 września 1990 r. obowiązywał limit 1000 mikrosimensów. Potem jednak limit został zwiększony do wartości 2000 mikrosimensów. W 2001 r. maksymalna dopuszczalna przewodność została ponownie zwiększona do 2500 mikrosimensów. Dopuszczalna wartość graniczna przewodności wynosi obecnie 2790 mikrosimensów. Woda pitna jest z pewnością najlepiej kontrolowaną żywnością w Niemczech. Jednak przestrzeganie lub kontrola czystych wartości granicznych nic nie mówi o jakości wody.
Dlatego naprawdę sensowne może być jednokrotne zmierzenie przewodności wody pitnej za pomocą urządzenia pomiarowego. Przydatne może być również oczyszczanie wody pitnej za pomocą urządzenia destylacyjnego lub systemu osmozy. Na przykład w procesie odwróconej osmozy woda jest przeciskana przez półprzepuszczalne membrany, pozostawiając za sobą zanieczyszczenia. To usuwa 95-99% substancji rozpuszczonych w wodzie i daje czystą wodę.
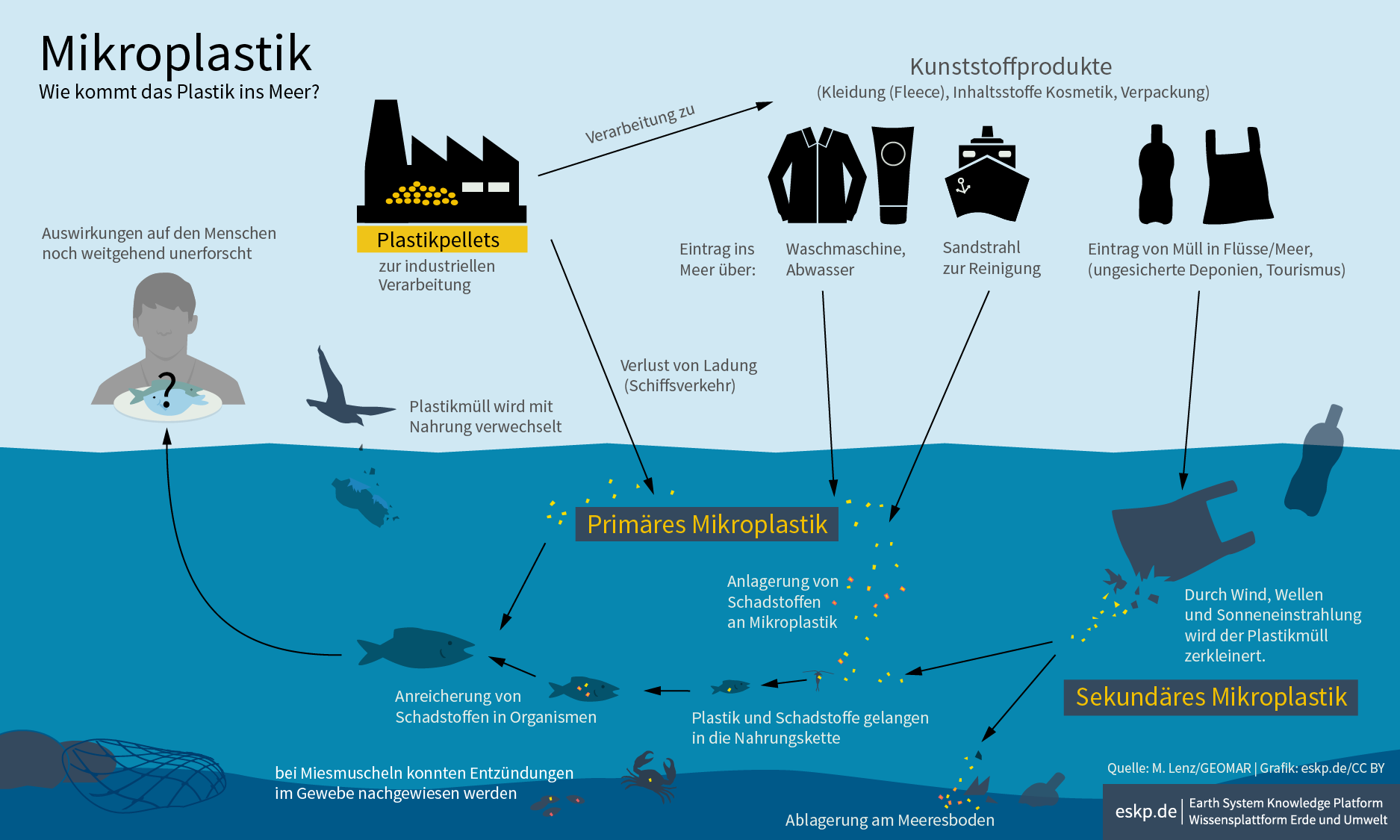
Drobne i niezwykle niebezpieczne: Mikroplastik w wodzie pitnej
Tworzywa sztuczne są praktyczne, wszechstronnie użyteczne – i dzisiaj nie do wyobrażenia bez nich nasze codzienne życie. Niestety, plastikowe torby, butelki i inne są również niezwykle trwałe. Gdy odpady z tworzyw sztucznych trafiają do środowiska, rozpadają się tam z czasem na najmniejsze cząsteczki, zwane mikroplastikiem, w rzekach, jeziorach i morzach. Ten działa jak magnes dla substancji toksycznych i ma znaczący wpływ na faunę morską. Po połknięciu przez najmniejsze organizmy morskie, ostatecznie ponownie trafia do naszego łańcucha pokarmowego.
„Życie w plastiku – to fantastyczne?” Nie ma mowy
Dla naszego środowiska odpady plastikowe i mikroplastik w wodzie pitnej są w każdym przypadku stale rosnącym problemem: Faktycznie, produkcja plastiku wzrosła od 1,5 megaton w 1950 roku do 322 megaton w 2015 roku. To ogromne ilości plastiku, które tylko częściowo są recyklowane lub poddawane recyklingowi termicznemu. Większość z nich trafia na wysypiska śmieci lub bezpośrednio do środowiska. Nasze jeziora, rzeki i morza także bardzo cierpią z tego powodu, mając do czynienia z rocznym napływem około 4,8 do 12,7 megaton plastikowych odpadów, co stanowi poważne zagrożenie dla fauny morskiej na wiele sposobów.
Od opon samochodowych do kosmetyków: Jak powstaje mikroplastik
Mikroplastik to stałe i nierozpuszczalne cząsteczki tworzywa sztucznego o rozmiarze mniejszym niż pięć milimetrów. Wyróżnia się mikroplastik pierwotny i wtórny. Mikroplastik pierwotny to tzw. granulki plastikowe, które są produkowane przez przemysł do dalszej obróbki. Na przykład występują one jako najdrobniejsze granulki plastiku i płynny plastik w produktach kosmetycznych. Ponieważ oczyszczalnie ścieków obecnie nie są w stanie wystarczająco wyfiltrować tych małych cząstek z odpływów, zostają one wypłukane prosto z naszych domów do środowiska i wód. Jak odkrył Instytut Fraunhofera ds. Ochrony Środowiska, Bezpieczeństwa i Technologii Energii w Oberhausen w 2018 roku, największą przyczyną mikroplastiku w naszym środowisku jest ścieranie opon samochodowych: Według studium, około jednej trzeciej emisji mikroplastiku jest tym właśnie spowodowana.
Pod pojęciem mikroplastiku wtórnego znajdują się części plastikowe, które przez działanie słońca, wiatru i fal są stopniowo rozdrabniane na coraz mniejsze granulki plastiku. Im mniejsze są te cząsteczki plastiku, tym większe jest ryzyko, że zostaną połknięte przez zwierzęta. Gdy mikroplastik raz znajdzie się w naturalnym obiegu, nie można go już z niego usunąć. Faktem jest: Mikroplastik jest dziś wszędzie, zarówno w lodzie arktycznym, jak i na dnie oceanu. Jakie będą tego długoterminowe konsekwencje, jest obecnie trudne do oszacowania. Dlatego tym bardziej istotne jest minimalizowanie spożycia plastiku na co dzień.
Cykl życia mikroplastiku – Źródło: Platforma Wiedzy eskp.de [CC BY 4.0 (https://creativecommons.org/licenses/by/4.0)]
Mikroplastik jest magnesem dla substancji toksycznych
Ze względu na swoje właściwości powierzchniowe, plastik przyciąga substancje toksyczne i trujące jak magnes. Faktycznie, stężenie substancji toksycznych na cząsteczkach mikroplastiku jest często sto razy większe niż w samej wodzie morskiej. Te toksyny są dalej rozprzestrzeniane poprzez łańcuch pokarmowy. Mikroplastik został już wykryty w fokach, rybach, małżach i mniejszych organizmach. Substancje toksyczne mogą być ponownie uwalniane w przewodzie pokarmowym i wpływać odpowiednio na organizm. Jakie będą tego skutki dla ludzi, jest dotychczas mało zbadane. Jednak dotychczasowe ustalenia w dziedzinie badań nad morzem i środowiskiem mogą być uznane za niepokojące. Badania wykazały już zmiany w tkankach, reakcje zapalne i toksyczne skutki, aż do fizjologicznych zaburzeń, zwiększonej częstości występowania nowotworów oraz znacznego wzrostu śmiertelności morskich zwierząt.
Mikroplastik w wodzie pitnej – Czy nasza woda z kranu jest zagrożona?
W 2017 roku nowe debaty na temat mikroplastiku wywołało wielkoskalowe amerykańskie badanie organizacji pozarządowej "Orb Media" we współpracy z Uniwersytetem Minnesota. Ogółem przebadano 159 próbek wody z całego świata i według tego badania w ponad 80 procentach znaleziono mikroplastik w wodzie pitnej. Europejskie próbki wody miały najmniejszą ilość mikroplastiku. Oprócz Francji i Wielkiej Brytanii, próbki niemieckie należały do najmniej skażonych, ale również nie były wolne od mikroplastiku.
Wiele ekspertów w Niemczech krytycznie ocenia wnioski badania i zwraca uwagę na błędy w metodologii. Na przykład, "czysta detekcja optyczna", czyli ocena tylko pod mikroskopem, według powszechnego poglądu, nie odpowiada już aktualnym standardom technicznym, jak zauważa Martin Jenkel, profesor oczyszczania wody na Uniwersytecie Technicznym w Berlinie. W porównawczych badaniach przeprowadzonych przez Instytut Alfreda Wegenera okazało się, że za pomocą mikroskopu świetlnego 60 do 100 razy więcej cząsteczek zostało błędnie zidentyfikowanych jako plastik. Choć badacze nadal znaleźli wodzie niewielkie ilości mikroplastiku, stężenia te były "bardzo niskie".
Mikroplastik, picie wody z kranu
Woda pitna w Niemczech jest doskonale kontrolowana, jak i w Polsce. Można założyć, że woda pitna w Niemczech jest kontrolowana w sposób bardziej rygorystyczny i częstszy niż woda butelkowana. Odkryła to między innymi fundacja Stiftung Warentest. Tylko co trzecia woda mineralna otrzymała ocenę "dobrą", znaleziono w niej tzw. "niepożądane ślady" z przemysłu, gospodarstw domowych lub rolnictwa. Także w wodzie butelkowanej znaleziono już cząsteczki plastiku.
W Niemczech około 80 procent wody pitnej pochodzi z wód gruntowych. Grube warstwy gleby, przez które przesiąkała, można uznać za doskonałe filtry. „W tej wodzie pitnej nie znajdują się na przykład wirusy, które mają wielkość mikroplastiku”, podkreśla Ingrid Chorus, ekspertka ds. wody pitnej z Federalnego Urzędu Ochrony Środowiska. Dlatego uważa, że jest bardzo mało prawdopodobne, aby ta woda była zanieczyszczona mikroplastikiem. „Jeśli spożywamy mikroplastik, to woda pitna jest najmniej istotną ścieżką”, podkreśla. Ponadto, jak w przypadku wszystkiego, zależy to od odpowiedniego stężenia.
Systemy filtracyjne Permatrade oczyszczają wodę poprzez mikrofiltrację i ją rewitalizują. Po takim zabiegu można się jej napić. Picie wody z kranu nadal można uznać za szczególnie zdrowe, zrównoważone, przyjazne dla środowiska i tanie – a przede wszystkim oczywiście za idealne rozwiązanie, aby ograniczyć kolejne odpady z plastiku z butelek PET. Osoby, które chcą cieszyć się dodatkowym bezpieczeństwem i chronić się przed zanieczyszczeniami z systemu rur, mogą dalej oczyszczać swoją wodę z kranu za pomocą specjalnych systemów filtracyjnych. Na przykład filtry blokujące z węglem aktywnym firmy perma-trade Wassertechnik zapewniają najwyższą czystość i higienę. Dzięki spiekanemu węglowi aktywnemu filtr ten ma niezwykle wysoką zdolność absorpcji i filtruje mikroplastiki, a także zmętnienia i zanieczyszczenia z cennej wody pitnej.
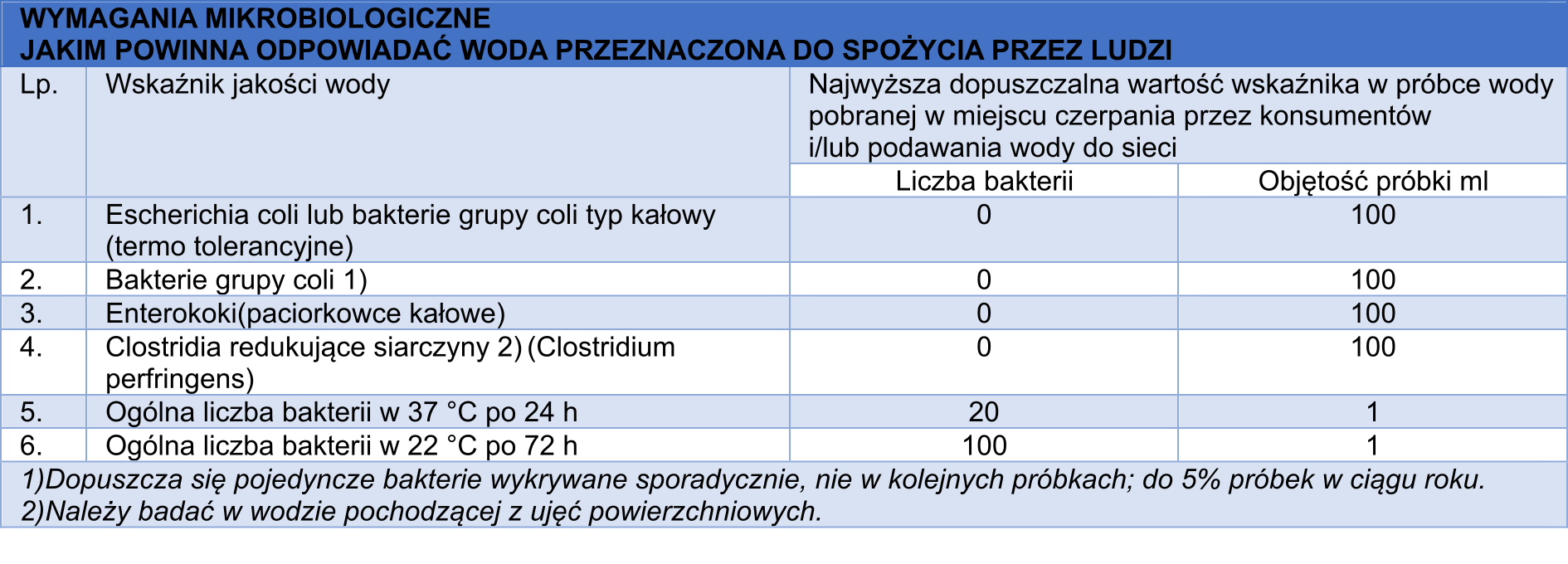
WYMAGANIA DOTYCZĄCE JAKOŚCI WODY PRZEZNACZONEJ DO SPOŻYCIA PRZEZ LUDZI
Rozporządzenie Ministra Zdrowia z dnia 7 grudnia 2017 r. (Dz.U. 2017 poz. 2294)


Wymagania mikrobiologiczne, jakim powinna odpowiadać ciepła woda, minimalna częstotliwość pobierania próbek ciepłej wody oraz procedury postępowania w zależności od wyników badania bakteriologicznego 1)

1) Należy badać w próbkach wody ciepłej pobranych w przedsiębiorstwach podmiotu wykonującego działalność leczniczą w rodzaju stacjonarne i całodobowe świadczenia zdrowotne i w budynkach zamieszkania zbiorowego oraz w budynkach użyteczności publicznej, w których w trakcie ich użytkowania wytwarzany jest aerozol wodno-powietrzny.
2) Wartość parametru dotyczy przedsiębiorstw podmiotu wykonującego działalność leczniczą w rodzaju stacjonarne i całodobowe świadczenia zdrowotne, w których przebywają pacjenci o obniżonej odporności, w tym objęci leczeniem immunopresyjnym.
WSKAŹNIKI JAKOŚCI WODY W INSTALACJACH CENTRALNEGO OGRZEWANIA
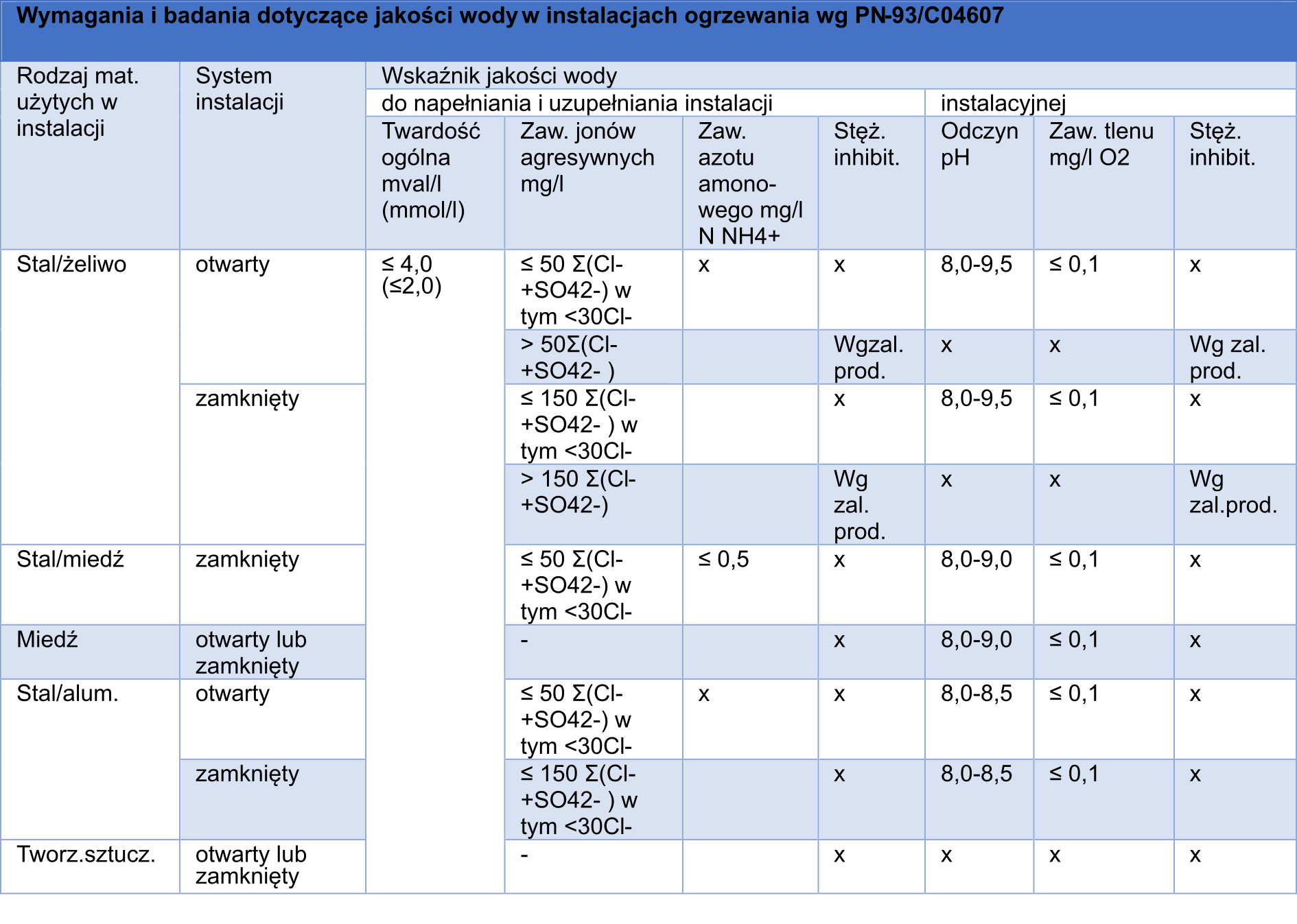
WYMAGANIA JAKOŚCI WODY OBIEGOWEJ W KOMORACH Z POWIERZCHNIAMI ZRASZANYMI
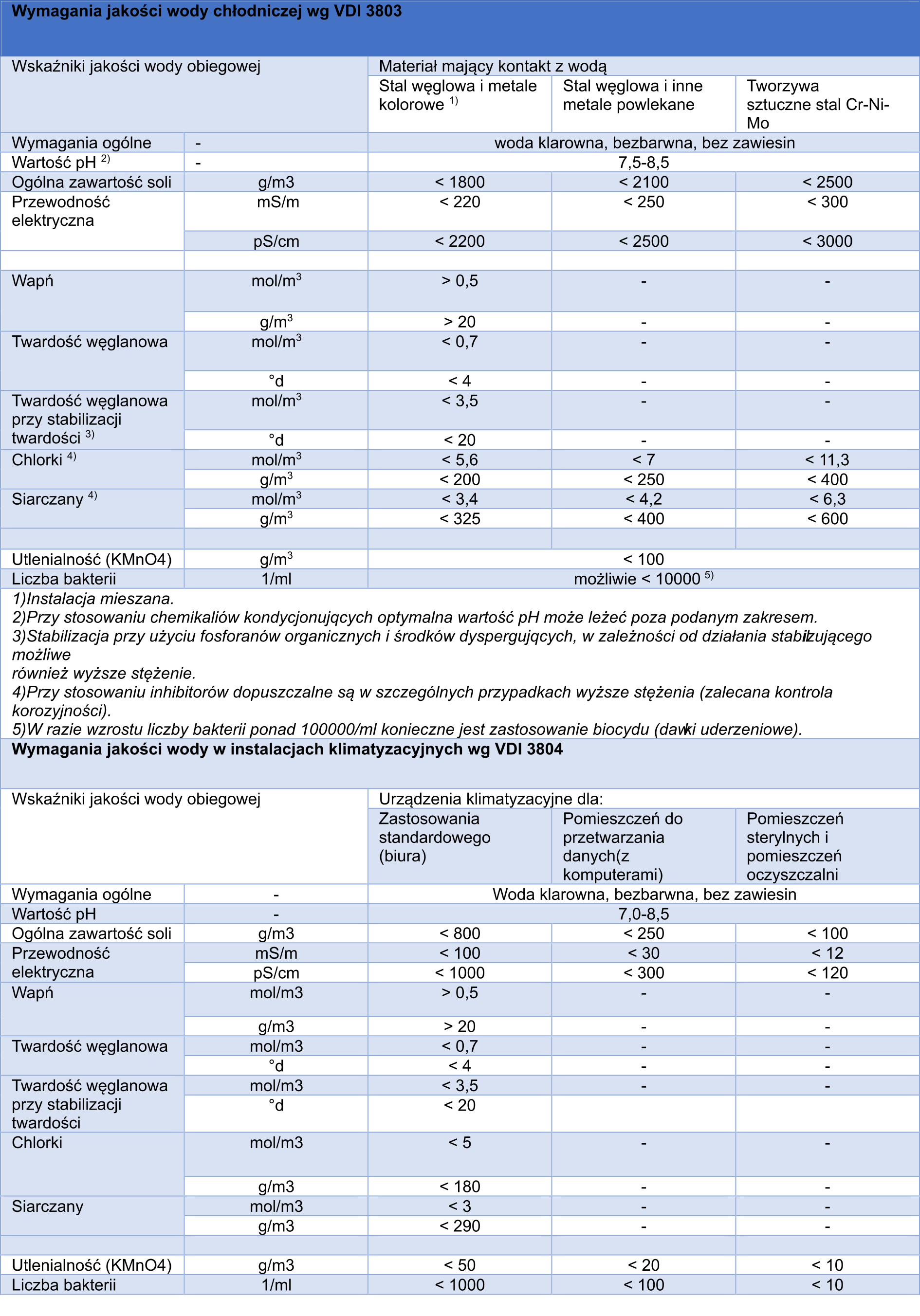
Zródło: Redakcja naukowa Jacek Nawrocki - Uzdatnianie wody Procesy fizyczne, chemiczne i biologiczne Część 2 - Wydawnictwo Naukowe UAM, Wydawnictwo Naukowe PWN Warszawa 2010